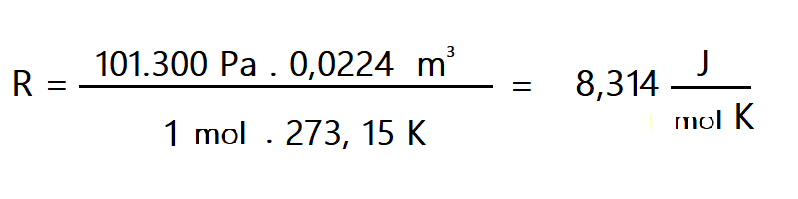"Las últimas partículas de los gases elementales no son átomos sino agregados de átomos, a los que dió el nombre de moléculas (del latín pequeñas masas).
Volúmenes iguales de gas, medidos en condiciones de presión y temperatura, contienen igual número de moléculas
Años después la muerte de Avogadro, su hipótesis aún no había sido aceptada. En el Congreso Internacional de Química de 1860 Stanislao Cannizzaro la defendió enérgicamente.
Siguiendo la hipótesis de Avogadro, Cannizzaro, determinó que el volumen ocupado por un mol de gas en condiciones normales de presión y temperatura, es decir a T = 273,15 K y P = 1 atm es: 22,4 litros. Aplicando estos valores a la ecuación de estado obtenemos el valor de R:.
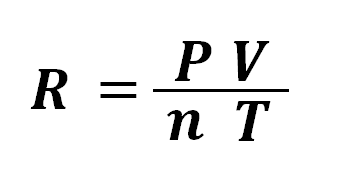
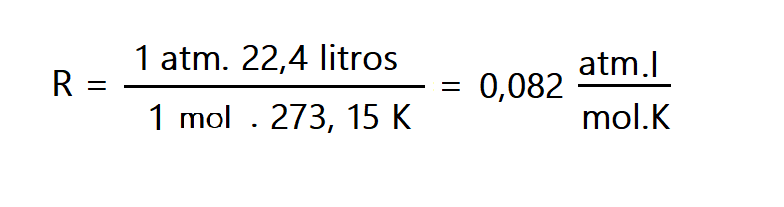
Pero atmósfera y litro no son unidades M.K.S.
En unidades M.K.S. P = 101.300 Pa y V = 0,0224 m3 y es: