Segundo Principio de la Termodiámica: Problemas
PROBLEMA 6.1.–
Cuatro litros de gas ideal diatómico (cv = 5/2 R) que están una presión P = 400 KPa, se expanden de manera isotérmica reversible hasta duplicar su volumen: a → b
Luego el gas se contráe a presión constante hasta el volumen inicial: b → c
Finalmente se lo calienta a volumen constante hasta que alcanza la presión original: c → a
a) Dibujar el ciclo en el diagrama P/V.
b) Calcular el rendimiento del ciclo.
c) ¿Cuál sería el rendimiento de una máquina de térmica de Carnot que operara entre las mismas temperaturas?
|
R: b) η = (309 J/ 3109 J) = 0,0994 c) ηCarnot = 0,5
PROBLEMA 6.2.–
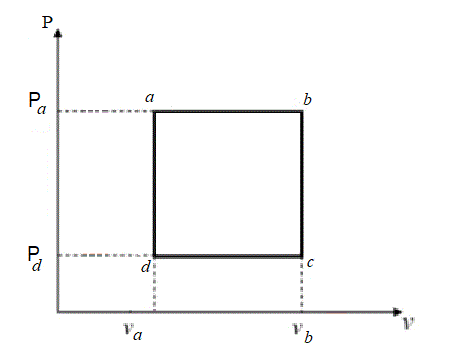
Dos moles de un gas ideal diatómico (cv=5/2R) describen un ciclo termodinámicos que está compuesto por cuatro trasformaciones: a→b isobárica, b→c isocórica, c→d isobárica y d→a isocórica.
El trabajo en la trasformación c→d es Wcd = -3.600 J
Datos:
Número de moles n = 2
Va = 20 litros
Vb = 40 litros
Temperatura en el estado a: Ta = 673 K.
Calcular
a) El calor en cada una de las trasformaciones.
b) El rendimiento η del ciclo.
c) ¿Cuál seria el rendimiento de una máquina térmica de Carnot con las mismas temperaturas extremas de este ciclo? |
 |
R: a) Qa-b = 39167,2 J Qb-c = -37953,22 J Qc-d = -12600 J Qd-a = 18976,6 J
PROBLEMA 6.3.–
Una máquina térmica trabaja entre dos fuentes cuyas temperaturas son a 100 K y 500 K.
En cada ciclo absorbe 1000 J de calor del foco caliente. Su rendimiento es del 20%.
a) Indicar si la máquina funciona reversible o irreversiblemente. Justificar
b) Determinar la variación de entropía ΔS del universo en cada ciclo.
c) Repetir el calculo anterior para una maquina de Carnot que utilice esas fuentes. |
Respuesta b) ΔSuniverso = 6 J/K
PROBLEMA 6.4.–
|
En un calorímetro ideal que contiene 900 g de agua a 27 ºC, se introducen 450 g de agua a 87 ºC. Calcular el aumento de entropía del universo. |
R: ΔS = 41,8 J/K
